- 首页
- 产品
-
信号通路
- 细胞进程相关信号通路(Cellular Processes)
- 细胞的环境信息应答相关信号通路(Environmental Information Processing)
- 人类疾病相关信号通路(Human Diseases)
-
机体系统相关通路研究(Organismal Systems)
- 免疫相关通路(Immune-Related Pathways)
- 造血与凝血相关通路(Hematopoietic & Coagulation-Related Pathways)
- 内分泌与代谢相关通路(Endocrine & Metabolic Pathways)
- 神经相关通路(Neural-Related Pathways)
- 心血管与肌肉相关通路(Cardiovascular & Muscle-Related Pathways)
- 发育与衰老相关通路(Development & Aging-Related Pathways)
- 节律与信号调控相关通路(Rhythm & Signal Regulation Pathways)
- 遗传信息调控相关信号通路(Genetic Information Processing)
- 支持中心
- 联系我们

肿瘤免疫学基础研究聚焦于肿瘤与免疫系统的相互作用机制,通过解析免疫逃逸、免疫细胞功能调控等关键问题,为免疫治疗提供新靶点和理论支撑,近期成果集中在免疫调控分子、细胞亚群功能及新型作用机制等领域。
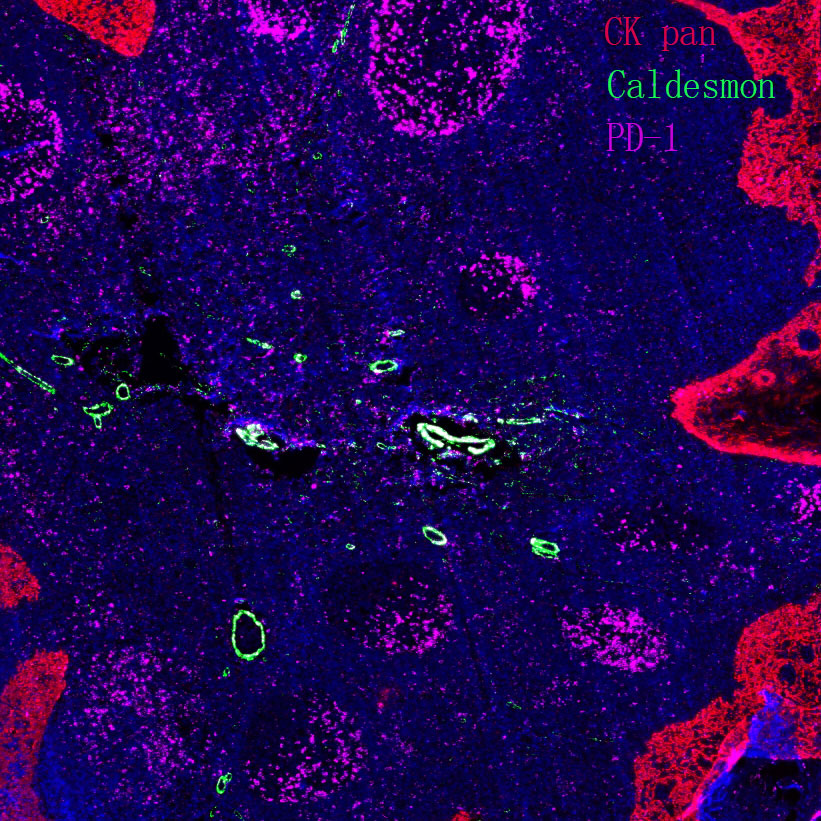
肿瘤免疫逃逸机制:肿瘤细胞通过表达 PD-L1、CD47 等 “别吃我” 信号,或分泌 TGF-β、IL-10 等免疫抑制因子,抑制 T 细胞、NK 细胞的杀伤功能。近期发现,肿瘤细胞释放的外泌体可携带 PD-L1,远程抑制全身免疫反应,这一机制为开发外泌体靶向药物提供了新思路。
免疫细胞亚群功能调控:CD8+T 细胞是杀伤肿瘤的核心力量,其耗竭状态(表达 PD-1、Tim-3 等抑制性受体)是免疫治疗耐药的关键。研究发现,转录因子 TOX 是 T 细胞耗竭的 “开关”,敲除 TOX 可恢复 T 细胞杀伤活性;此外,调节性 T 细胞(Treg)的代谢重编程(如依赖脂肪酸氧化)使其在肿瘤微环境中持续存活,靶向这一代谢特征可增强抗肿瘤免疫。
新型免疫调控分子与靶点:除了经典的 PD-1/PD-L1、CTLA-4 通路,近年发现 NKG2A、LAG-3 等抑制性受体,以及 STING、cGAS 等天然免疫通路分子。其中,STING 激动剂可激活树突状细胞,增强抗原呈递能力,目前已进入临床前研究阶段。
肿瘤微生物组与免疫的相互作用:肠道菌群通过代谢产物(如短链脂肪酸)调控全身免疫反应,特定菌群(如双歧杆菌、 Akkermansia 菌)可增强 PD-1 抑制剂的疗效。基础研究证实,菌群失衡会导致免疫耐受,而菌群移植可重塑抗肿瘤免疫微环境。
这些基础研究为肿瘤免疫治疗提供了多个突破方向,比如针对 TOX 的小分子抑制剂、STING 激动剂与 PD-1 抑制剂的联合用药,以及基于菌群调控的联合治疗方案。未来有望通过精准靶向免疫调控通路,解决免疫治疗耐药、适用人群有限等问题,推动肿瘤治疗向个性化、精准化方向发展。
相关资源链接