- 首页
- 产品
-
信号通路
- 细胞进程相关信号通路(Cellular Processes)
- 细胞的环境信息应答相关信号通路(Environmental Information Processing)
- 人类疾病相关信号通路(Human Diseases)
-
机体系统相关通路研究(Organismal Systems)
- 免疫相关通路(Immune-Related Pathways)
- 造血与凝血相关通路(Hematopoietic & Coagulation-Related Pathways)
- 内分泌与代谢相关通路(Endocrine & Metabolic Pathways)
- 神经相关通路(Neural-Related Pathways)
- 心血管与肌肉相关通路(Cardiovascular & Muscle-Related Pathways)
- 发育与衰老相关通路(Development & Aging-Related Pathways)
- 节律与信号调控相关通路(Rhythm & Signal Regulation Pathways)
- 遗传信息调控相关信号通路(Genetic Information Processing)
- 支持中心
- 联系我们

Western Blot(WB)检测详细流程 (仅供参考)
Western Blot(蛋白质印迹法)核心是通过电泳分离蛋白质,再经免疫反应特异性检测目标蛋白,流程需严格控制每一步以确保结果准确,具体步骤如下:
1、实验前准备
2、蛋白定量与上样
3、SDS-PAGE电泳
4、转膜
5、封闭与抗体孵育
6、检测与结果分析
一、实验前准备
1. 试剂准备:配制或准备好裂解缓冲液(含蛋白酶/磷酸酶抑制剂)、蛋白定量试剂(如BCA试剂盒)、SDS-PAGE电泳试剂(凝胶储备液、Tris-甘氨酸电泳缓冲液、上样缓冲液)、转膜缓冲液、封闭液(如5%脱脂牛奶)、一抗/二抗(按比例用抗体稀释液稀释)、化学发光检测底物。
2. 器材准备:电泳槽、转膜仪、硝酸纤维素膜(NC膜)或PVDF膜(需用甲醇激活)、滤纸、移液器、离心管、凝胶成像系统等。
3. 样本准备:根据样本类型(细胞/组织)处理,细胞用胰酶消化后离心收集,组织需匀浆;加入预冷的裂解缓冲液,冰上裂解30分钟,4℃、12000rpm离心15分钟,取上清即为蛋白样本。
二、蛋白定量与上样
1. 蛋白定量:按BCA试剂盒说明书操作,将标准品和样本与BCA工作液混合,37℃孵育30分钟,用酶标仪测562nm吸光度,根据标准曲线计算样本蛋白浓度。
2. 样本处理:按定量结果,取等量蛋白样本与上样缓冲液(含β-巯基乙醇)混合,100℃煮沸5-10分钟使蛋白变性,冷却后备用。
3. 凝胶制备:根据目标蛋白分子量选择分离胶浓度(小分子选高浓度,大分子选低浓度),先灌分离胶,加一层水封胶,凝固后倒掉水,再灌浓缩胶,插入梳子,待凝胶完全凝固后拔出梳子。
4. 上样:将凝胶放入电泳槽,倒入Tris-甘氨酸电泳缓冲液,在加样孔中加入处理好的蛋白样本和蛋白Marker(用于分子量参考)。
三、SDS-PAGE电泳
1. 浓缩胶阶段:接通电源,设置电压为80V,电泳至溴酚蓝指示剂进入分离胶(约20-30分钟)。
2. 分离胶阶段:将电压调至120V,继续电泳至溴酚蓝指示剂到达凝胶底部(约60-90分钟),关闭电源,取出凝胶。
四、转膜
1. 转膜组装:按“负极→滤纸→凝胶→膜→滤纸→正极”顺序组装转膜三明治,确保各层无气泡(气泡会阻碍蛋白转移),膜的大小需与凝胶一致。
2. 转膜操作:将转膜三明治放入转膜仪,倒入预冷的转膜缓冲液,根据膜类型和蛋白分子量设置转膜条件(如PVDF膜常用200mA恒流,转膜时间30-90分钟),转膜过程中保持低温(可在转膜槽外放置冰盒)。
3. 转膜验证:转膜结束后,可将膜用丽春红染液染色5分钟,若能看到清晰的蛋白Marker条带,说明转膜成功,随后用TBST缓冲液洗去染液。
五、封闭与抗体孵育
1. 封闭:将转膜后的膜放入封闭液中,室温摇床孵育1-2小时(或4℃过夜),目的是封闭膜上的非特异性结合位点,减少背景干扰。
2. 一抗孵育:弃去封闭液,用TBST洗膜3次,每次10分钟;加入稀释好的特异性一抗,4℃摇床孵育过夜(或室温孵育2小时),使一抗与目标蛋白特异性结合。
3. 二抗孵育:弃去一抗,用TBST洗膜3次,每次10分钟;加入稀释好的荧光标记或酶标记(如HRP)二抗,室温摇床孵育1小时,使二抗与一抗特异性结合。
4. 洗膜:弃去二抗,用TBST洗膜3次,每次10分钟,彻底去除未结合的二抗,避免影响后续检测。
六、检测与结果分析
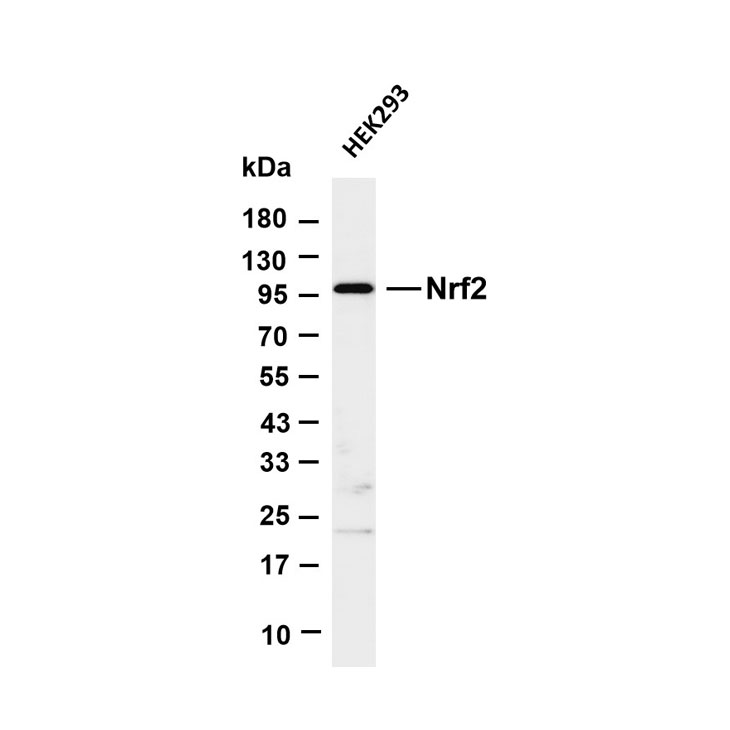
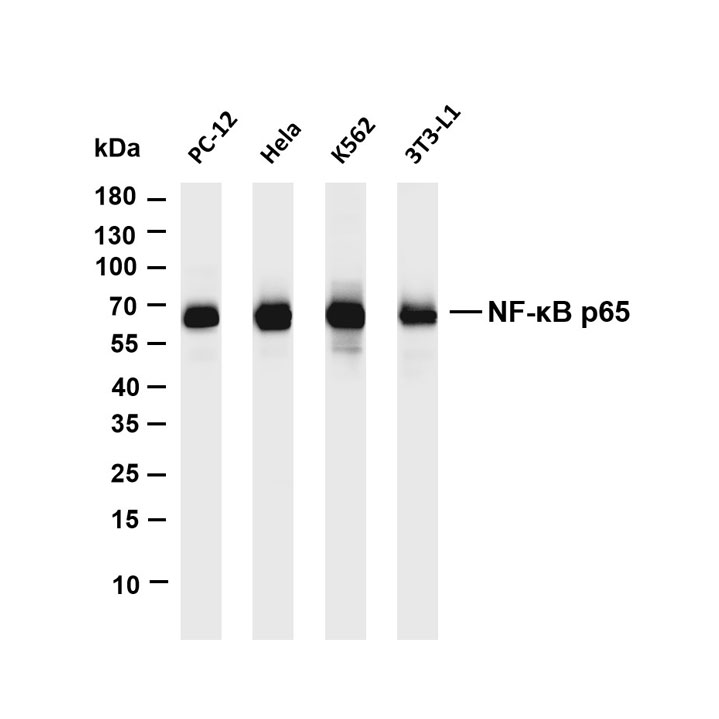
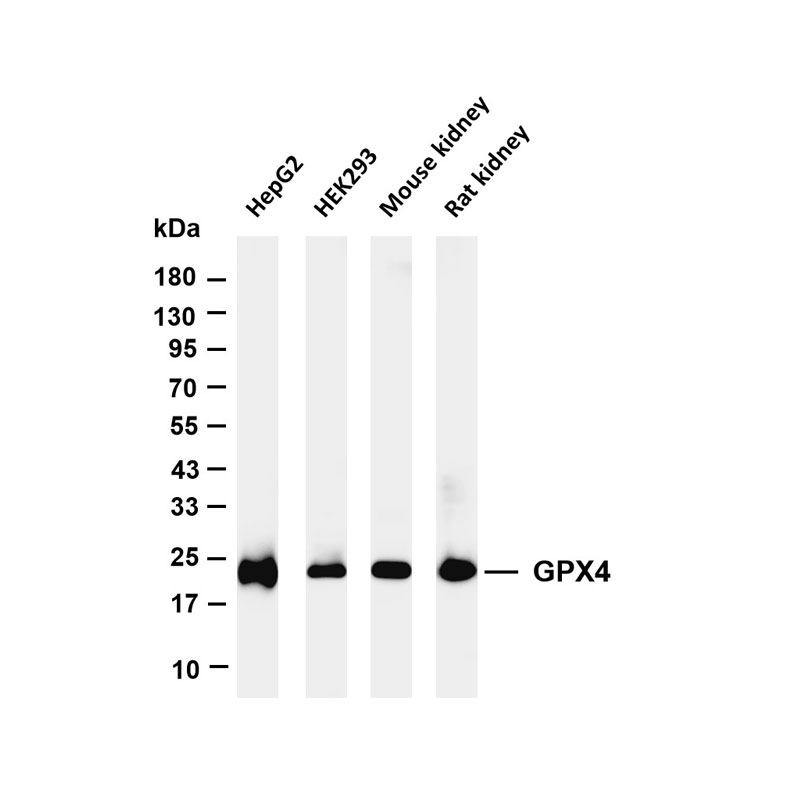
1. 化学发光检测:将膜取出,用滤纸吸干表面液体,均匀滴加化学发光检测底物(如ECL底物),孵育1-2分钟后,放入凝胶成像系统中曝光,根据条带亮度调整曝光时间,获取清晰的蛋白条带图像。
2. 结果分析:用图像分析软件(如ImageJ)对蛋白条带进行灰度值分析,以目的蛋白条带灰度值与内参蛋白(如GAPDH、β-actin)条带灰度值的比值,表示目的蛋白的相对表达量,进而分析样本中目标蛋白的表达差异。
Related Resource Links
Related Promotional Journal Downloads