- 首页
- 产品
-
信号通路
- 细胞进程相关信号通路(Cellular Processes)
- 细胞的环境信息应答相关信号通路(Environmental Information Processing)
- 人类疾病相关信号通路(Human Diseases)
-
机体系统相关通路研究(Organismal Systems)
- 免疫相关通路(Immune-Related Pathways)
- 造血与凝血相关通路(Hematopoietic & Coagulation-Related Pathways)
- 内分泌与代谢相关通路(Endocrine & Metabolic Pathways)
- 神经相关通路(Neural-Related Pathways)
- 心血管与肌肉相关通路(Cardiovascular & Muscle-Related Pathways)
- 发育与衰老相关通路(Development & Aging-Related Pathways)
- 节律与信号调控相关通路(Rhythm & Signal Regulation Pathways)
- 遗传信息调控相关信号通路(Genetic Information Processing)
- 支持中心
- 联系我们

细胞死亡机制研究是解码生命稳态调控规律、解析重大疾病病理本质、构建创新治疗体系的核心枢纽,其意义贯穿基础生命科学、疾病机制研究与临床转化医学三大领域:
在基础层面,它揭示了胚胎发育(如指间细胞凋亡介导指趾分化)、成体组织稳态(如每日百亿级衰老 / 受损细胞清除)及天然免疫防御(如焦亡介导病原体清除)的底层逻辑,填补多细胞生物复杂调控网络的认知空白;
在疾病层面,细胞死亡异常是癌症(肿瘤细胞逃逸凋亡、适应新型死亡抗性)、神经退行性疾病(神经元过度凋亡 / 坏死性凋亡)、炎症性疾病(焦亡 / 坏死性凋亡引发炎症失控)的共性病理基础,为阐明病因提供关键靶点;
在临床层面,其直接推动治疗创新,既催生了 Bcl-2 抑制剂(治疗慢性淋巴细胞白血病)、GPX4 抑制剂(诱导肿瘤铁死亡)等落地或在研药物,又能绕开传统治疗耐药性、提升治疗特异性,为解决人类健康关键问题与临床难题提供根本理论支撑与技术路径。
细胞凋亡是最经典的程序性死亡,WB 检测需重点关注Caspase 家族激活、Bcl-2 家族平衡及线粒体通路标志物,核心是区分 “全长(非活性)” 与 “切割片段(活性)”。
标志物类别 | 具体蛋白 / 分子 | WB 检测要点 |
执行型 Caspase | Caspase-3、Caspase-7 | 需检测切割片段(Caspase-3:17/19 kDa,全长 32 kDa),推荐用含 SDS 的裂解液避免人工激活。 |
启动型 Caspase | Caspase-8、Caspase-9 | Caspase-8(外源性通路,切割片段 43/41 kDa);Caspase-9(内源性通路,切割片段 37 kDa)。 |
Bcl-2 家族 | Bcl-2、Bax、Bak | 重点看Bax/Bcl-2 比值(促凋亡 / 抗凋亡);Bak 需用非还原性电泳检测寡聚化状态。 |
线粒体释放因子 | 细胞色素 C(Cytochrome C) | 需做亚细胞分级(分离线粒体 / 胞质组分),仅胞质中检测到信号才提示凋亡激活。 |
凋亡晚期标志 | PARP-1 | 检测切割片段(89 kDa,全长 116 kDa),可同时识别全长与片段的抗体更准确。 |
辅助标志物 | Smac/DIABLO、XIAP | Smac(胞质积累提示线粒体损伤);XIAP(凋亡抑制蛋白,下调可辅助验证凋亡)。 |
焦亡核心是Gasdermin 家族切割与炎症因子释放,WB 需聚焦 “孔道形成蛋白” 和 “Caspase 炎症亚型”,同时需结合炎症因子检测。
标志物类别 | 具体蛋白 / 分子 | WB 检测要点 |
关键执行蛋白 | GSDMD、GSDME | GSDMD(切割片段 31 kDa,全长 53 kDa);GSDME(切割片段 35 kDa,全长 50 kDa),是焦亡特异性标志。 |
炎症 Caspase | Caspase-1、Caspase-4/5/11 | Caspase-1(切割片段 20/10 kDa,全长 45 kDa);Caspase-4/5/11(切割片段 20 kDa 左右)。 |
炎症因子 | IL-1β、IL-18 | 需检测成熟型(IL-1β:17 kDa,前体 31 kDa;IL-18:18 kDa,前体 24 kDa),常需结合 ELISA 验证。 |
辅助标志物 | NLRP3 | 检测蛋白表达量(全长 110 kDa),需注意其活化依赖寡聚化,WB 仅能反映表达水平,需结合免疫共沉淀辅助。 |
坏死性凋亡是 “Caspase 非依赖” 的炎性死亡,WB 核心是RIPK3-MLKL 通路激活,重点检测 “磷酸化修饰”(活性形式)。
标志物类别 | 具体蛋白 / 分子 | WB 检测要点 |
核心激酶 | RIPK1、RIPK3 | 需检测磷酸化形式(p-RIPK1:Ser166;p-RIPK3:Ser227/Thr231),总蛋白表达量参考价值低。 |
执行蛋白 | MLKL | 关键看磷酸化 MLKL(p-MLKL:Ser358),活性形式会向细胞膜转位,可做亚细胞定位辅助。 |
辅助标志物 | Caspase-8 | 检测全长(55 kDa),坏死性凋亡时 Caspase-8 活性被抑制,无切割片段(避免与凋亡混淆)。 |
铁死亡是 “铁依赖 - 脂质过氧化” 介导的死亡,WB 无 “切割片段” 标志,需检测关键调控蛋白表达及 “脂质过氧化相关分子”。
标志物类别 | 具体蛋白 / 分子 | WB 检测要点 |
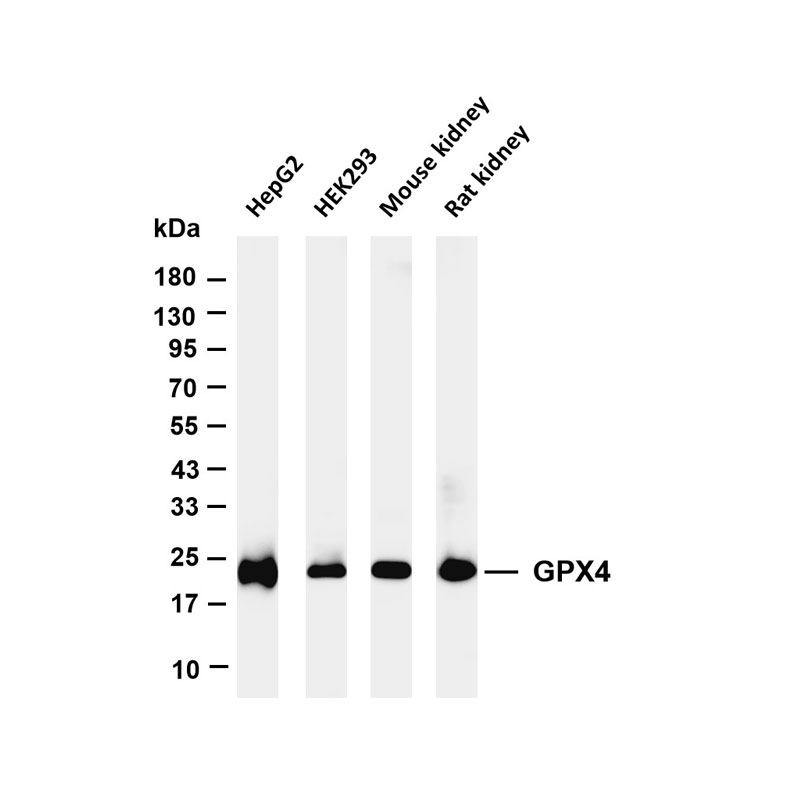
核心调控蛋白 | GPX4、SLC7A11 | GPX4(22 kDa,表达下调是铁死亡核心标志);SLC7A11(55 kDa,抑制后诱导铁死亡)。 |
脂质代谢相关 | ACSL4、LPCAT3 | ACSL4(72 kDa,促进脂质过氧化);LPCAT3(50 kDa,维持膜脂组成,下调敏感)。 |
铁代谢相关 | FTH1、TFR1 | FTH1(21 kDa,铁储存蛋白,下调导致铁释放);TFR1(90 kDa,铁摄取蛋白,上调提示铁积累)。 |
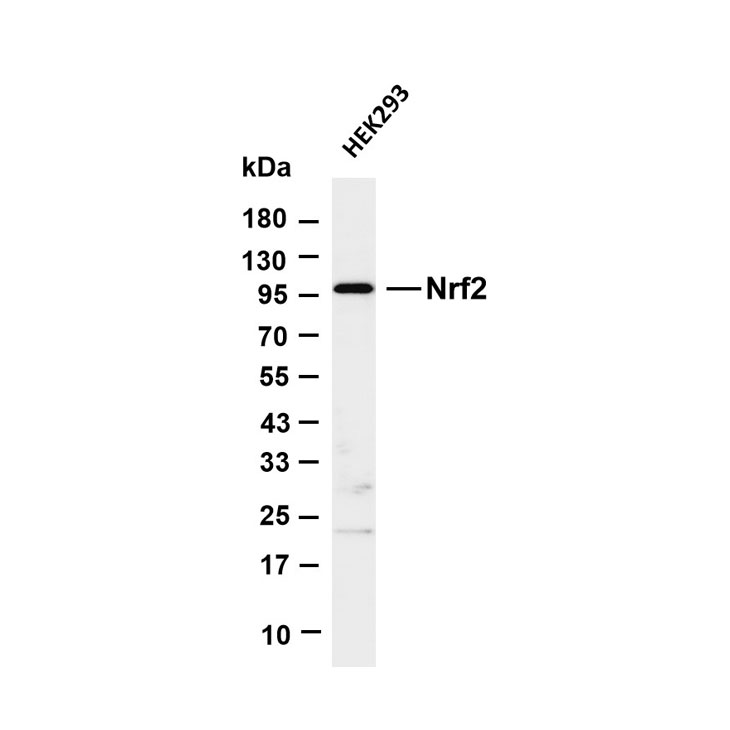
辅助标志物 | Nrf2 | 抗氧化通路关键因子(65 kDa,铁死亡时激活,表达上调)。 |
铜死亡是 “铜依赖 - 线粒体代谢异常” 死亡,WB 需关注FDX1 - 脂酰化蛋白通路及 “线粒体 TCA 循环相关蛋白”。
标志物类别 | 具体蛋白 / 分子 | WB 检测要点 |
核心调控因子 | FDX1、LIAS | FDX1(20 kDa,铜毒性关键介导因子,敲除可挽救铜死亡);LIAS(50 kDa,脂酰合酶,下调抑制脂酰化)。 |
脂酰化相关蛋白 | DLAT、PDHA1 | DLAT(51 kDa,TCA 循环蛋白,铜结合后聚集,可检测可溶性 / 不溶性组分);PDHA1(43 kDa,脂酰化下调)。 |
铜转运蛋白 | SLC31A1、ATP7A/B | SLC31A1(35 kDa,铜输入蛋白,过表达增强铜敏感性);ATP7A/B(160 kDa,铜输出蛋白,下调导致铜积累)。 |
辅助标志物 | HSP70 | 热休克蛋白(70 kDa,铜死亡时蛋白毒性应激,表达上调)。 |
自噬是 “溶酶体降解” 过程,WB 核心是LC3 lipidation(脂化) ,需区分 “LC3-I(游离)” 与 “LC3-II(膜结合)”。
标志物类别 | 具体蛋白 / 分子 | WB 检测要点 |
核心标志 | LC3B | 检测 LC3-I(18 kDa)与 LC3-II(16 kDa),LC3-II/LC3-I 比值升高提示自噬激活;需用 PE 抗体增强信号。 |
自噬调控蛋白 | Beclin1、ULK1 | Beclin1(60 kDa,自噬起始关键因子,上调促进自噬);ULK1(150 kDa,检测磷酸化形式 p-ULK1:Ser555)。 |
自噬底物 | p62/SQSTM1 | 48 kDa,自噬激活时被降解,表达下调;若与 LC3-II 同时升高,提示自噬流受阻。 |
溶酶体相关 | LAMP1 | 110 kDa,溶酶体膜蛋白,表达上调提示溶酶体活性增强,辅助验证自噬流。 |
相关资源链接