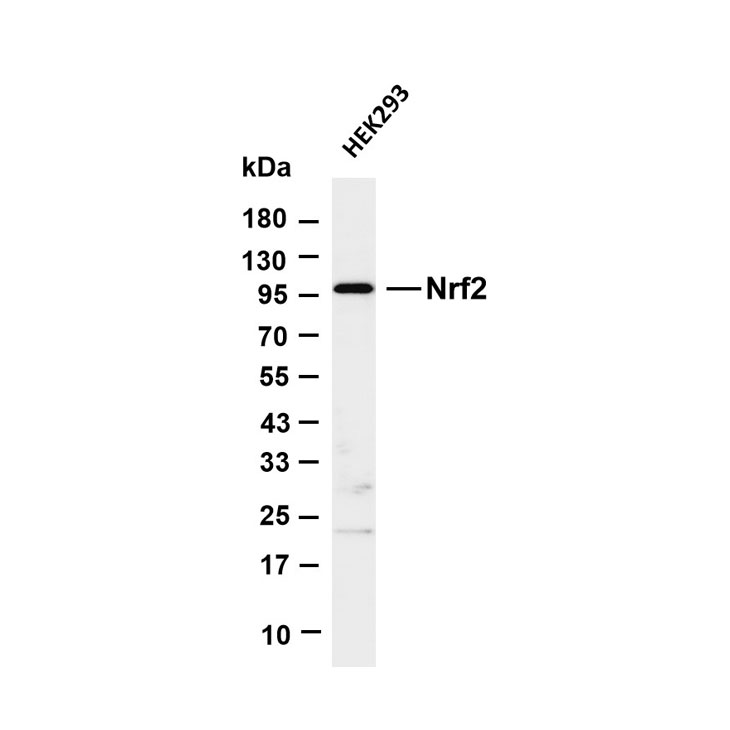
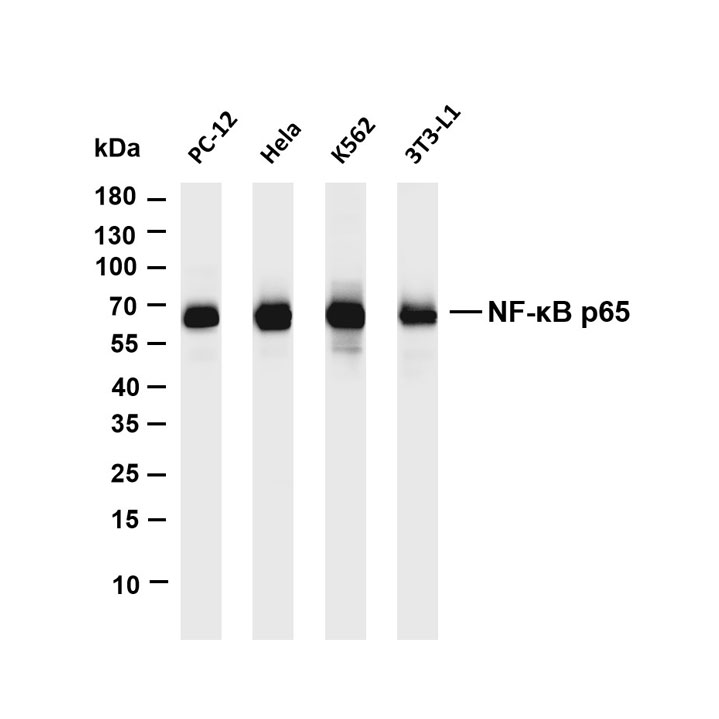
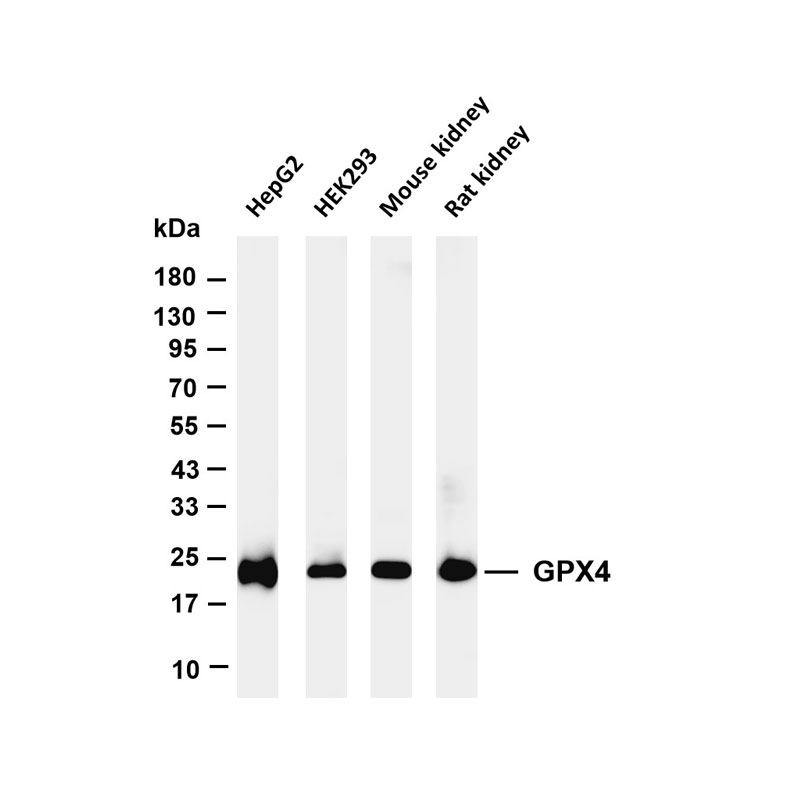
一、样本制备相关问题
1. 蛋白浓度过低
现象描述 | 可能原因 | 解决方案 |
无信号或信号极弱 | 1. 初始样品量过少;
2. 组织 / 细胞破碎不充分,蛋白未完全释放;
3. 提取缓冲液体积过多,导致蛋白被过度稀释;
4. 蛋白吸附到离心管、匀浆器等容器壁;
5. 提取过程中蛋白发生降解 | 1. 适当增加样品量,确保组织 / 细胞总量满足提取需求;
2. 优化破碎方式:组织样本使用玻璃匀浆器充分研磨,细胞样本可结合超声破碎(功率 300~500W,超声 3~5 次,每次 10~20s,间隔 30s);
3. 调整样品与提取缓冲液比例(建议 1:3~1:5,如 100mg 组织加入 300~500μL 缓冲液);
4. 使用硅化处理的离心管,提取缓冲液中加入 0.1%~0.5% Triton X-100 减少蛋白吸附;
5. 全程冰上操作,提取缓冲液中添加新鲜蛋白酶抑制剂(如 PMSF 终浓度 1mM,蛋白酶抑制剂鸡尾酒 1:100 稀释) |
2. 蛋白降解
现象描述 | 可能原因 | 解决方案 |
多条杂带,目标条带模糊、弥散,或分子量低于预期 | 1. 提取缓冲液未加或加入失效的蛋白酶抑制剂;
2. 样品反复冻融(超过 3 次),导致蛋白结构破坏、降解;
3. 提取、离心过程温度过高(未在 4℃或冰上操作);
4. 样品处理时间过长,蛋白酶持续作用 | 1. 提取前新鲜添加蛋白酶抑制剂,对于易降解蛋白可额外加入磷酸酶抑制剂;
2. 样品提取后分装(每管 50~100μL),-80℃冻存,避免反复冻融;
3. 离心机预冷至 4℃,所有操作在冰上进行,缩短样品暴露在室温的时间;
4. 优化处理流程,样品裂解后尽快离心(12000rpm,4℃,10~15min)取上清,避免长时间放置 |
3. 蛋白聚集
现象描述 | 可能原因 | 解决方案 |
拖尾或块状条带 | 1. 蛋白浓度过高(超过 5mg/mL),导致分子间相互作用聚集;
2. 提取缓冲液离子强度不适(过高或过低)
3. 还原剂(β- 巯基乙醇、DTT)失效,蛋白二硫键未被打开,形成聚集体;
4. 样品煮沸时间过长(超过 15 分钟),导致蛋白变性过度聚集 | 1. 适当稀释样品(浓度调整至 1~3mg/mL),或减少上样量;
2. 使用标准配方的提取缓冲液(如 RIPA 缓冲液:50mM Tris-HCl pH7.4,150mM NaCl,1% Triton X-100),确保离子强度稳定;
3. 新鲜添加还原剂(β- 巯基乙醇终浓度 5%,或 DTT 终浓度 100mM),还原剂需避光保存;
4. 样品煮沸 5~10 分钟即可,煮沸后置于冰上冷却 5 分钟再上样;5. 对于难溶解的膜蛋白,可在缓冲液中加入 2% SDS 或 1% NP-40 辅助溶解 |
二、电泳相关问题
1. 条带扭曲、变形
现象描述 | 可能原因 | 解决方案 |
电泳后条带呈微笑状,或条带边缘不整齐、倾斜 | 1. 凝胶配制不均匀(丙烯酰胺浓度不一致),导致电场分布不均;
2. 电泳缓冲液浓度过高或过低(如 Tris - 甘氨酸缓冲液应稀释 10 倍使用);
3. 上样量过多(每孔超过 20μL),样品溢出或拥挤;
4. 电泳电压 / 电流过高,导致凝胶发热、变形;
5. 梳子插入过深或过浅,加样孔形状不规则 | 1. 配制凝胶时充分搅拌,确保丙烯酰胺与双丙烯酰胺混合均匀,聚合前避免剧烈晃动;
2. 按说明书稀释电泳缓冲液,使用新鲜配制的缓冲液(避免反复使用超过 3 次);
3. 控制上样量(每孔 10~20μL,蛋白总量 20~50μg),若样品量多可分多次上样;
4. 采用恒压电泳(浓缩胶 80V,分离胶 120V),避免电压过高,电泳槽外可放置冰袋降温;
5. 梳子插入凝胶时预留 1~2mm 距离,确保加样孔平整,拔梳时动作轻柔 |
2. 条带拖尾、弥散
现象描述 | 可能原因 | 解决方案 |
条带呈弥散状,或拖尾 | 1. 样品中盐浓度过高,导致电泳时电场紊乱;
2. Loading Buffer 添加不足或失效(如溴酚蓝褪色);
3. 凝胶浓度与目标蛋白分子量不匹配(如小分子蛋白用高浓度凝胶,大分子蛋白用低浓度凝胶);
4. 电泳时间过长,条带跑出凝胶;
5. 蛋白未完全变性(如煮沸不充分) | 1. 若样品盐浓度高,可通过透析或超滤法脱盐,或减少上样量;
2. 确保 Loading Buffer 与样品比例为 1:4(如 40μL 样品加 10μL 5×Loading Buffer),使用新鲜配制的 Loading Buffer;
3. 根据目标蛋白分子量选择凝胶浓度:小分子(<30kDa)用 12%~15% 分离胶,中分子(30~100kDa)用 8%~12% 分离胶,大分子(>100kDa)用 6%~8% 分离胶;
4. 电泳前计算大致时间,避免条带跑出(可通过溴酚蓝指示,溴酚蓝到达凝胶底部 1~2cm 时停止电泳);
5. 样品煮沸 5~10 分钟,确保蛋白完全变性,煮沸后冰浴冷却 |
三、转膜相关问题
问题类型 | 可能原因 | 解决方案 |
转膜不完全 | 1. 转膜时间 / 电压 / 电流不足;
2. 转膜三明治存在气泡(接触不良);
3. 转膜缓冲液配方 / 浓度异常;
4. 膜孔径选择错误;
5. 凝胶与膜位置颠倒 | 1. 按蛋白分子量调整转膜参数(<30kDa:100V/20-30min;30-100kDa:100V/40-60min;>100kDa:100V/60-90min);
2. 转膜前浸泡组件,逐层排除气泡;
3. 使用标准缓冲液(25mM Tris+192mM 甘氨酸 + 20% 甲醇);
4. 小分子选 0.2μm 膜,中大分子选 0.45μm 膜;5. 正确组装:阴极→滤纸→凝胶→膜→滤纸→阳极 |
转膜过度 | 1. 转膜时间过长 / 电压 / 电流过高;
2. 膜孔径过大;
3. 缓冲液甲醇浓度过高(>30%) | 1. 缩短转膜时间,降低电压 / 电流(如 100V 降至 80V);
3. 更换更小孔径膜(小分子换 0.2μm);
3. 调整甲醇浓度至 20% |
膜上条带模糊 / 高背景 | 1. 转膜温度过高(未降温);
2. 膜 / 凝胶 / 滤纸大小不匹配;
3. 转膜缓冲液陈旧;
4. PVDF 膜未用甲醇激活 | 1. 转膜时冰浴降温(控制 4℃左右);
2. 确保组件大小一致(膜略大于凝胶);
3. 使用新鲜配制的缓冲液;
4. PVDF 膜用甲醇浸泡 10-30 秒激活(NC 膜无需) |
四、孵育相关问题
问题类型 | 可能原因 | 解决方案 |
无目标条带(孵育环节) | 1. 一抗 / 二抗失效或浓度过低;
2. 抗体与样品种属 / 抗原不匹配;
3. 孵育时间 / 温度不当;
4. 封闭过度掩盖抗原表位;5. 洗膜过度导致抗体脱落 | 1. 按说明书调整抗体稀释比(一抗 1:500~1:10000,二抗 1:10000~1:50000),分装冻存避免反复冻融;
2. 确认抗体种属特异性与抗原匹配性;
3. 优化孵育条件(一抗 4℃过夜或 37℃1~2h,二抗 37℃1h 或室温 2h);
4. 用 5% 脱脂奶粉 / 3% BSA 封闭 1~2h(室温),避免高浓度 / 长时间封闭;5. 用含 0.1% Tween-20 的 TBST 洗膜 3 次(每次 5~10min) |
背景过高(非特异性条带多) | 1. 一抗 / 二抗浓度过高;
2. 封闭不充分(液种不当 / 时间短);
3. 抗体交叉反应;
4. 洗膜不彻底;
5. 孵育 / 洗膜时膜干燥 | 1. 降低抗体浓度(如一抗 1:500 改为 1:1000);
2. 按需选封闭液(蛋白类用 5% 脱脂奶粉,磷酸化蛋白用 3% BSA),室温封闭 2h;
3. 选单克隆一抗,二抗匹配一抗种属;
4. 用含 0.1%~0.2% Tween-20 的 TBST 洗膜 4~5 次(每次 10min);
5. 全程确保膜浸泡在液体中 |
条带不均一 | 1. 抗体孵育未摇匀,分布不均;
2. 封闭液 / 抗体有沉淀;
3. 膜与抗体溶液接触不良;
4. 洗膜水流冲击导致局部抗体脱落 | 1. 孵育时用摇床(50~100rpm)摇匀,确保抗体覆盖膜;
2. 试剂使用前 10000rpm 离心 5min 去沉淀;
3. 按每 cm² 膜≥100μL 准备抗体溶液,选合适孵育容器;
4. 洗膜时轻晃容器,避免水流直冲击膜 |
五、显色相关问题
问题类型 | 核心原因 | 解决方案 |
无显色信号 / 信号极弱 | 1. 发光底物失效(过期 / 未避光保存);
2. 底物孵育时间不足;
3. 叠氮钠抑制 HRP 酶活性;
4. 曝光时间过短 | 1. 使用有效期内发光底物,避光冷藏保存;
2. 底物充分浸泡膜,室温孵育 1~5min;
3. 封闭 / 洗膜液避免加叠氮钠;
4. 延长曝光至 1~5min,或换高灵敏度底物 |
背景发亮(无清晰条带) | 1. 发光底物过量 / 孵育过久;
2. 二抗浓度过高 / 洗膜不充分;
3. 膜上残留蛋白 / 抗体沉淀 | 1. 底物孵育后轻吸膜表面多余液体,缩短孵育至 1~2min;
3. 降低二抗浓度,增加洗膜次数;
3. 试剂使用前离心去除沉淀 |
条带拖尾 / 晕圈 | 1. 底物未吸干导致扩散;
2. 转膜时蛋白扩散;
3. 抗体浓度过高致非特异性结合 | 1. 吸干膜表面多余底物,避免扩散;
2. 优化转膜条件(缩短时间 / 降低电压);
3. 降低一抗 / 二抗浓度 |
五、总结
Western Blot 实验的成功依赖于样本制备、电泳、转膜、孵育、显色等每个环节的精细化操作。关键注意事项如下:
样本处理全程保持低温,添加抑制剂防止蛋白降解和聚集;
凝胶、缓冲液需新鲜配制,确保电泳和转膜条件稳定;
抗体选择需匹配样本种属和目标蛋白,严格控制稀释比例和孵育条件;
封闭和洗膜要充分,避免背景过高或信号丢失;
显色底物需妥善保存,曝光时间根据信号强度灵活调整。
实验前建议做好阳性对照(如已知表达目标蛋白的细胞裂解液)和阴性对照(如未转染的细胞裂解液),便于快速排查问题。若出现异常结果,可按 “样本→电泳→转膜→孵育→显色” 的顺序逐一排查,结合具体现象调整实验参数,以获得稳定、可靠的结果。
Related Promotional Journal Downloads