- 首页
- 产品
-
信号通路
- 细胞进程相关信号通路(Cellular Processes)
- 细胞的环境信息应答相关信号通路(Environmental Information Processing)
- 人类疾病相关信号通路(Human Diseases)
-
机体系统相关通路研究(Organismal Systems)
- 免疫相关通路(Immune-Related Pathways)
- 造血与凝血相关通路(Hematopoietic & Coagulation-Related Pathways)
- 内分泌与代谢相关通路(Endocrine & Metabolic Pathways)
- 神经相关通路(Neural-Related Pathways)
- 心血管与肌肉相关通路(Cardiovascular & Muscle-Related Pathways)
- 发育与衰老相关通路(Development & Aging-Related Pathways)
- 节律与信号调控相关通路(Rhythm & Signal Regulation Pathways)
- 遗传信息调控相关信号通路(Genetic Information Processing)
- 支持中心
- 联系我们

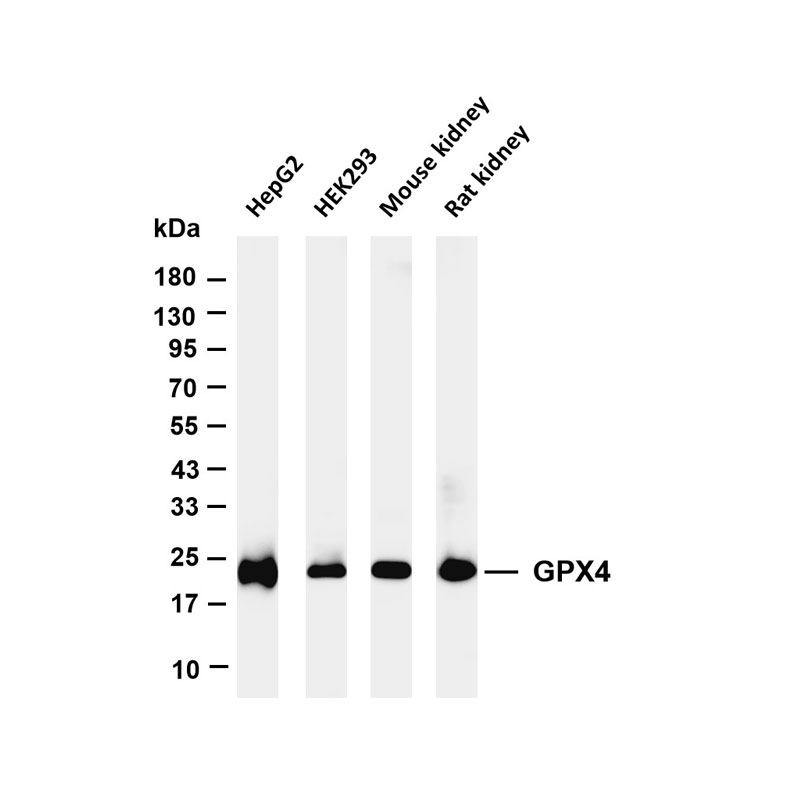
免疫沉淀(Immunoprecipitation, IP)详细Protocol (仅供参考)
免疫沉淀(IP)核心是利用特异性抗体与目标蛋白结合,再通过 Protein A/G 等介质捕获抗体-抗原复合物,从而从复杂样本中分离纯化目标蛋白,具体步骤如下:
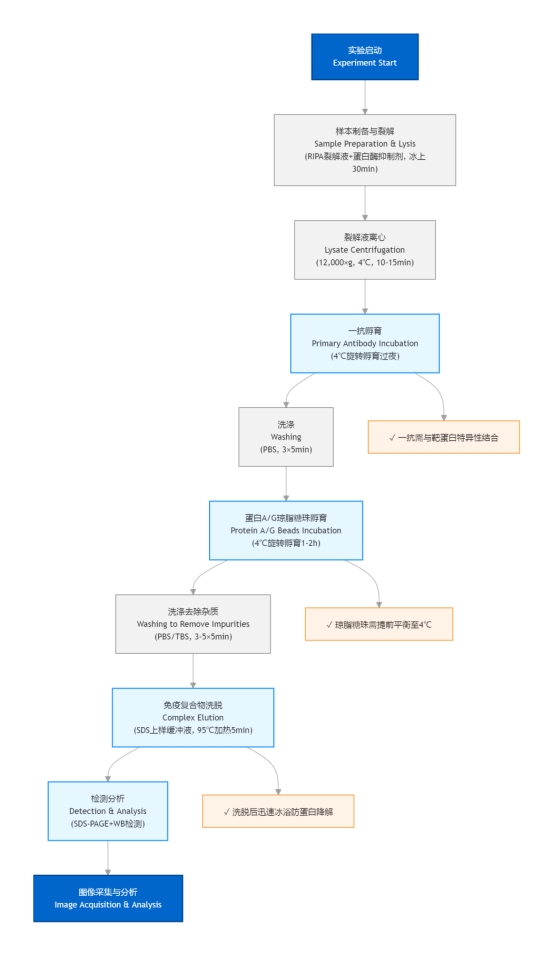
1实验前准备
2抗体与 Protein A/G 珠偶联
3抗原捕获
4洗脱目标蛋白
5后续检测
一、实验前准备
1. 试剂准备:
- 基础试剂:细胞裂解液(如 RIPA 裂解液,含蛋白酶抑制剂、磷酸酶抑制剂,防止蛋白降解/去磷酸化)、PBS(pH7.4)、洗涤缓冲液(含 0.1% Triton X-100 的 PBS,去除非特异性结合)、2×SDS 上样缓冲液。
- 核心试剂:特异性一抗(针对目标蛋白)、阴性对照抗体(如无关 IgG,排除非特异性结合)、Protein A/G 磁珠/琼脂糖珠(用于捕获抗体-抗原复合物)。
2. 器材准备:离心机、移液器及吸头、离心管/EP 管、磁力架(磁珠专用)、摇床、蛋白定量试剂盒(如 BCA 试剂盒)。
3. 样本预处理:
- 细胞样本:收集对数期细胞,用预冷 PBS 洗涤 2 次,弃尽 PBS 后加入预冷的裂解液(每 1×10⁶ 细胞加 100-200μL),冰上裂解 30 分钟,4℃、12000rpm 离心 15 分钟,取上清(即总蛋白提取物),BCA 法测定蛋白浓度。
- 组织样本:将组织剪碎,加入预冷裂解液(每 50mg 组织加 500μL),匀浆后冰上裂解 30 分钟,后续同细胞样本离心取上清。
二、抗体与 Protein A/G 珠偶联(形成“抗体-珠”复合物)
1. 取适量 Protein A/G 磁珠(每 500μg 总蛋白用 20-50μL 磁珠),加入 500μL 预冷 PBS,轻轻颠倒混匀,磁珠吸附后弃上清(琼脂糖珠需 4℃、3000rpm 离心 3 分钟收集),重复洗涤 2 次。
2. 向洗涤后的磁珠中加入特异性一抗(按抗体说明书用量,通常 1-5μg),阴性对照孔加入等量无关 IgG,再补加 PBS 至 200μL,4℃ 摇床缓慢孵育 1-2 小时(或室温孵育 30 分钟),使抗体与磁珠充分结合。
3. 孵育结束后,用洗涤缓冲液洗涤磁珠 3 次,每次 500μL,去除未结合的游离抗体,最后一次洗涤后弃尽上清,备用。
三、抗原捕获(“抗体-珠”复合物结合目标蛋白)
1. 取总蛋白提取物(通常 200-500μg 蛋白),用裂解液补至体积 500μL,加入上述制备好的“抗体-珠”复合物,4℃ 摇床缓慢孵育 4-6 小时(或过夜,确保抗原充分结合)。
2. 孵育结束后,用洗涤缓冲液洗涤复合物 4-5 次,每次 500μL(磁珠用磁力架吸附,琼脂糖珠离心收集),最后一次洗涤后尽量吸尽上清(避免残留杂质影响后续检测)。
四、洗脱目标蛋白
1. 向洗涤后的“抗体-珠-抗原”复合物中加入 20-50μL 2×SDS 上样缓冲液,轻轻吹打混匀。
2. 沸水浴加热 5-10 分钟(或 95℃ 加热 15 分钟),使目标蛋白从复合物中解离。
3. 磁珠样本:磁力架吸附磁珠,取上清(含目标蛋白);琼脂糖珠样本:4℃、12000rpm 离心 5 分钟,取上清。
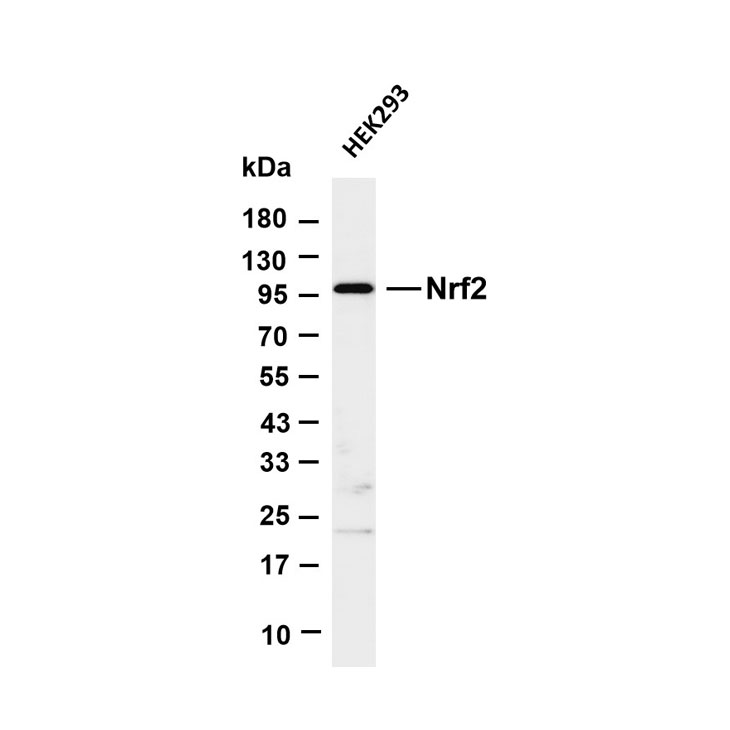
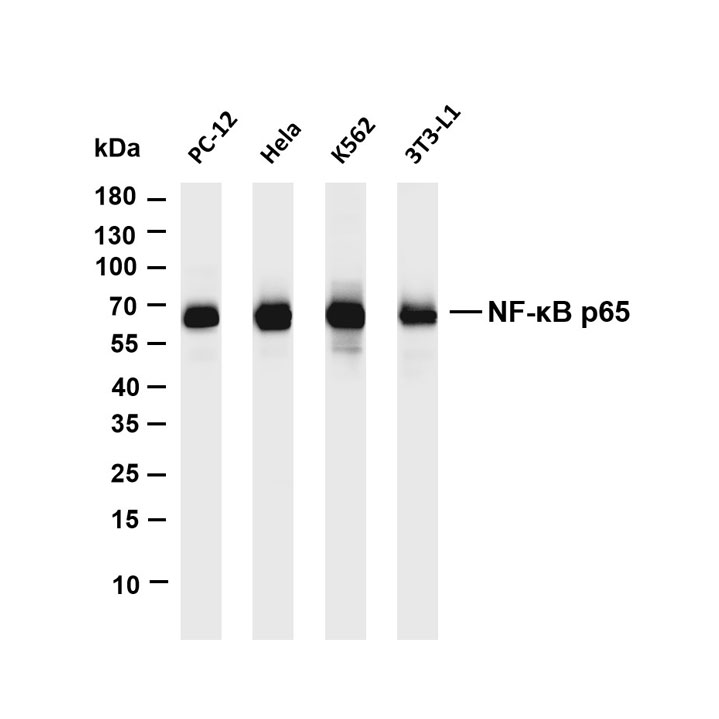
五、后续检测(以 Western Blot 为例)
1. 将洗脱的蛋白样本上样至 SDS-PAGE 凝胶,进行电泳分离。
2. 转膜、封闭后,用目标蛋白的特异性一抗(可与 IP 所用一抗相同或针对不同表位)孵育,再用 HRP 标记二抗孵育。
3. 显影曝光,观察目标蛋白条带(阴性对照 IgG 组应无明显条带,排除非特异性结合)。
关键注意事项
- 所有试剂需预冷,操作全程在冰上或 4℃ 进行,减少蛋白降解。
- 裂解液中必须加入蛋白酶/磷酸酶抑制剂,根据目标蛋白(如磷酸化蛋白需加磷酸酶抑制剂)调整。
- 阴性对照(无关 IgG)和阳性对照(已知含目标蛋白的样本)需同步设置,确保实验结果可靠。
- 磁珠/琼脂糖珠洗涤需充分,避免残留的游离抗体干扰 Western Blot 结果。
Related Resource Links
Related Promotional Journal Downloads