- 首页
- 产品
-
信号通路
- 细胞进程相关信号通路(Cellular Processes)
- 细胞的环境信息应答相关信号通路(Environmental Information Processing)
- 人类疾病相关信号通路(Human Diseases)
-
机体系统相关通路研究(Organismal Systems)
- 免疫相关通路(Immune-Related Pathways)
- 造血与凝血相关通路(Hematopoietic & Coagulation-Related Pathways)
- 内分泌与代谢相关通路(Endocrine & Metabolic Pathways)
- 神经相关通路(Neural-Related Pathways)
- 心血管与肌肉相关通路(Cardiovascular & Muscle-Related Pathways)
- 发育与衰老相关通路(Development & Aging-Related Pathways)
- 节律与信号调控相关通路(Rhythm & Signal Regulation Pathways)
- 遗传信息调控相关信号通路(Genetic Information Processing)
- 支持中心
- 联系我们

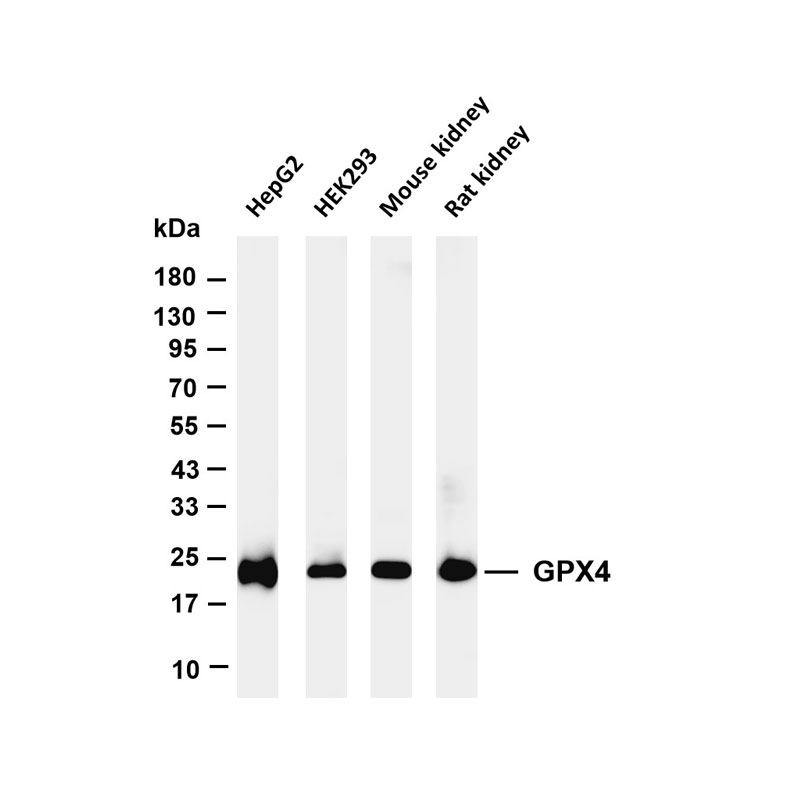
纤维化基础研究聚焦组织损伤后异常修复的分子机制,核心是解析成纤维细胞活化、细胞外基质过度沉积的调控网络,为器官纤维化(如肺、肝、心、肾)的靶向治疗提供理论支撑,最新进展集中在核心调控通路、细胞互作及新型干预靶点等领域。
成纤维细胞是纤维化的核心效应细胞,其异常活化(转化为肌成纤维细胞)是关键步骤。 转化生长因子 β(TGF-β)/Smad 通路是经典调控轴,TGF-β 可诱导成纤维细胞分泌胶原蛋白,近期发现 Smad7 甲基化会增强该通路活性,成为纤维化进展的 “加速器”。
代谢重编程是活化新特征,肌成纤维细胞依赖糖酵解供能,靶向糖酵解关键酶(如己糖激酶 2)可抑制其增殖与胶原合成。
ECM 过度积累导致组织硬化,其成分与结构异常进一步加剧损伤。
基质金属蛋白酶(MMPs)与组织抑制因子(TIMPs)失衡是核心,TIMPs 过度表达会抑制 ECM 降解,近期发现 MMP-14 可通过降解纤维连接蛋白,缓解肝纤维化。
胶原蛋白交联修饰(如赖氨酸氧化酶介导)增强 ECM 稳定性,相关酶类已成为重要干预靶点。
免疫系统在纤维化中扮演 “桥梁” 角色,免疫细胞分泌的细胞因子调控成纤维细胞功能。 巨噬细胞亚群失衡关键,M2 型巨噬细胞分泌 IL-13、IL-4,促进成纤维细胞活化;而 γδT 细胞可分泌 IFN-γ,抑制纤维化进展。
中性粒细胞释放的中性粒细胞胞外诱捕网(NETs),可通过激活 TLR4 通路诱导成纤维细胞活化,这一机制在肺纤维化中已被证实。
表观遗传修饰参与纤维化的可逆调控,为治疗提供新维度。
组蛋白去乙酰化酶(HDACs)可沉默抗纤维化基因,HDAC6 抑制剂已在动物实验中显示出缓解肾纤维化的效果。
microRNA(如 miR-29、miR-146a)通过靶向 TGF-β 受体或胶原蛋白基因,调控纤维化进程,miR-29 模拟物已进入临床前研究。
肺纤维化:聚焦上皮 - 间质转化(EMT)、NETs 形成机制,以及 STING 通路介导的炎症 - 纤维化串联反应。
肝纤维化:围绕肝星状细胞活化的代谢调控,以及肠道菌群代谢产物(如胆汁酸)对肝纤维化的影响。
心肌纤维化:关注 FBLN7、USP53 等分子(与此前心血管研究呼应),及其对心肌 ECM 沉积的调控作用。
肾纤维化:聚焦足细胞损伤与成纤维细胞交叉对话,以及缺氧诱导因子(HIF)通路的调控作用。
相关资源链接