- 首页
- 产品
-
信号通路
- 细胞进程相关信号通路(Cellular Processes)
- 细胞的环境信息应答相关信号通路(Environmental Information Processing)
- 人类疾病相关信号通路(Human Diseases)
-
机体系统相关通路研究(Organismal Systems)
- 免疫相关通路(Immune-Related Pathways)
- 造血与凝血相关通路(Hematopoietic & Coagulation-Related Pathways)
- 内分泌与代谢相关通路(Endocrine & Metabolic Pathways)
- 神经相关通路(Neural-Related Pathways)
- 心血管与肌肉相关通路(Cardiovascular & Muscle-Related Pathways)
- 发育与衰老相关通路(Development & Aging-Related Pathways)
- 节律与信号调控相关通路(Rhythm & Signal Regulation Pathways)
- 遗传信息调控相关信号通路(Genetic Information Processing)
- 支持中心
- 联系我们

流式细胞术(Flow Cytometry, FCM)详细实验步骤(仅供参考)
流式细胞术(FCM)是一种高通量分析技术,利用荧光标记抗体与细胞中目标分子(如表面抗原、胞内蛋白)特异性结合,当细胞穿过激光束时,检测并定量单个细胞的荧光信号,可快速分析细胞表型、活性及功能状态。
以下为详细实验步骤(以表面抗原免疫表型分析为例):
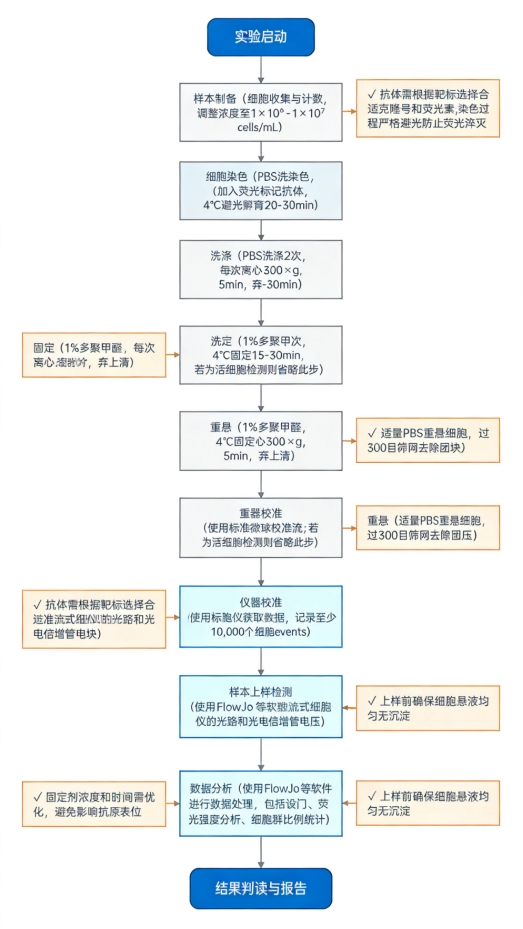
一、实验前准备
1. 试剂准备
基础试剂:磷酸盐缓冲液(PBS,pH7.4)、胎牛血清(FBS,用于封闭非特异性结合)、细胞消化液(如无 EDTA 胰酶,适用于贴壁细胞)、7 - 氨基放线菌素 D(7-AAD,用于活性染色)、固定液(4% 多聚甲醛,胞内染色时使用)、通透液(含 0.1% Triton X-100 的 PBS,胞内染色时使用)。
核心试剂:荧光标记一抗(如 FITC/PE/APC 标记的目标表面抗原特异性抗体)、同型对照抗体(与一抗物种及荧光素一致,用于排除非特异性结合)、荧光标记二抗(使用未标记一抗时需搭配)。
2. 器材准备
流式细胞仪(配备对应荧光素检测激光)、离心机、移液器及吸头、流式管(12×75mm 聚苯乙烯管)、生物安全柜、培养箱(37℃,5% CO₂)。
3. 样本预处理
悬浮细胞:收集对数生长期细胞,4℃、300×g 离心 5 分钟,弃上清。预冷 PBS 洗涤 2 次,用含 2% FBS 的 PBS 重悬,调整细胞浓度至 1×10⁶ cells/mL。
贴壁细胞:弃去培养基,预冷 PBS 洗涤 1 次。加入适量细胞消化液,37℃孵育 2-5 分钟至细胞脱落。用完全培养基终止消化,转移至流式管,4℃、300×g 离心 5 分钟。预冷 PBS 洗涤 2 次,用含 2% FBS 的 PBS 重悬,调整细胞浓度至 1×10⁶ cells/mL。
组织来源细胞:将组织剪碎,用胶原酶 / 胰酶混合液 37℃消化 30-60 分钟,经 70μm 细胞滤网过滤获得单细胞悬液。后续离心洗涤步骤同前,调整细胞浓度至 1×10⁶ cells/mL。
二、封闭非特异性结合
向每个流式管中加入 100μL 细胞悬液(约 1×10⁵个细胞)。
每管加入 5-10μL FBS(或 Fc 受体特异性封闭液),轻轻混匀。
室温孵育 15-20 分钟(或 4℃孵育 30 分钟),封闭细胞表面 Fc 受体,减少非特异性抗体结合。
三、抗体孵育
1. 表面抗原染色
每管加入适量荧光标记一抗(按说明书操作,如 1×10⁵个细胞加入 1-5μL)。
同型对照管加入等体积同型对照抗体(与一抗物种及荧光素匹配)。
轻轻涡旋混匀,4℃避光孵育 30-60 分钟(避光防止荧光素淬灭)。
孵育结束后,每管加入 2mL 预冷 PBS,4℃、300×g 离心 5 分钟,弃上清。重复洗涤 2 次,去除未结合的游离抗体。
2. 胞内抗原染色(可选)
表面抗原染色及洗涤后,每管加入 100μL 4% 多聚甲醛固定液,室温孵育 15-20 分钟固定细胞。
500×g 离心 5 分钟,弃上清。PBS 洗涤 1 次。
加入 100μL 通透液,室温孵育 10-15 分钟通透细胞膜。
500×g 离心 5 分钟,弃上清。用含 2% FBS 的 PBS 洗涤 1 次。
加入胞内抗原特异性荧光标记一抗,4℃避光孵育 30-60 分钟。
PBS 洗涤 2 次,重悬细胞待检测。
四、活性染色(可选)
最终洗涤后,用 100μL 预冷 PBS 重悬细胞。
每管加入 1-2μL 7-AAD 染色液,轻轻混匀。
室温避光孵育 5-10 分钟(7-AAD 结合死细胞 DNA,可排除死细胞干扰)。
五、流式上机样本制备
染色后的细胞 4℃、300×g 离心 5 分钟,弃上清。
用 300-500μL 预冷 PBS(或鞘液)重悬细胞,获得单细胞悬液(避免细胞团聚堵塞流式细胞仪喷嘴)。
将细胞悬液经 40-70μm 细胞滤网过滤至新的流式管(去除团块及杂质,保证检测准确性)。
样本上机前置于冰上避光保存(1 小时内完成检测,维持细胞活性及荧光素稳定性)。
六、流式细胞仪操作与数据采集
提前 30-60 分钟开启流式细胞仪,预热激光并稳定系统。
用标准微球(如荧光校准微球)校准仪器,确保荧光信号检测准确性及补偿设置合理性。
设置检测参数:根据抗体荧光素选择对应激光及检测器(如 FITC:488nm 激光,530nm 发射光;PE:488nm 激光,575nm 发射光;APC:633nm 激光,660nm 发射光)。
调整前向散射光(FSC)和侧向散射光(SSC)参数,圈选目标细胞群体(如根据 FSC/SSC 散点图排除碎片及死细胞)。
将样本管放入流式细胞仪,设置采集体积或事件数(每样本通常采集 10,000-50,000 个事件,保证统计显著性)。
依次采集所有样本(包括同型对照、未染色对照及单染补偿对照),数据以 FCS 格式保存。
七、数据分析
使用流式分析软件(如 FlowJo、FCS Express)打开采集的 FCS 数据。
圈门策略:
首先通过 FSC vs SSC 圈选总细胞群体,排除碎片及细胞团块。
对于活性染色样本,通过 7-AAD vs FSC 圈选活细胞(排除 7-AAD 阳性死细胞)。
以同型对照设置阳性染色阈值(同型对照阳性率通常为 1-2%)。
定量分析:计算各目标抗原阳性细胞百分比及阳性细胞平均荧光强度(MFI,反映目标分子表达水平)。
统计分析:使用统计软件(如 GraphPad Prism)比较实验组间阳性细胞百分比或 MFI 差异,生成散点图、直方图或等高线图可视化结果。
关键注意事项:
实验操作中所有试剂及样本需置于冰上或 4℃环境(特定孵育步骤除外),维持细胞活性并防止抗原降解。
荧光抗体对光敏感,所有孵育及样本处理步骤需在避光条件下进行或使用不透光试管,避免荧光素淬灭。
同型对照、未染色对照及单染补偿对照是校正非特异性结合及设置补偿的关键(多色流式实验必需)。
细胞浓度及悬液质量至关重要:避免细胞浓度过高(易导致团聚)或过低(降低数据可靠性)。
多色染色时,需选择荧光素无重叠的抗体组合,并进行补偿校准,消除通道间荧光溢出。
严格遵循流式细胞仪操作规程,实验结束后清洁仪器,防止喷嘴堵塞及交叉污染。
Related Resource Links
Related Promotional Journal Downloads