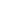染色质免疫沉淀实验(Chromatin Immunoprecipitation Assay, ChIP)详细步骤(仅供参考)
染色质免疫沉淀(ChIP)是研究蛋白质与 DNA 相互作用的核心技术,通过甲醛交联固定细胞内 DNA - 蛋白质复合物,利用特异性抗体富集目标蛋白结合的染色质片段,经解交联、DNA 纯化后,通过 qPCR 或测序(ChIP-seq)检测目标蛋白结合的 DNA 序列,可精准分析转录因子结合位点、组蛋白修饰分布等表观遗传调控机制。以下为详细实验步骤:
一、实验前准备
1. 试剂准备
基础试剂:PBS 缓冲液(pH7.4,预冷)、16% 甲醛溶液(用于交联,需新鲜配制)、甘氨酸溶液(1.25M,用于终止交联)、细胞裂解液(Lysis Buffer,含蛋白酶抑制剂)、核裂解液(Nuclear Lysis Buffer,含蛋白酶抑制剂、SDS)、ChIP 洗涤缓冲液(低盐缓冲液、高盐缓冲液、锂盐缓冲液、TE 缓冲液,均预冷)、洗脱液(含 1% SDS、0.1M NaHCO₃)、NaCl 溶液(5M,用于解交联)、蛋白酶 K 溶液(20mg/mL)、RNase A 溶液(10mg/mL)、酚 - 氯仿 - 异戊醇混合液(25:24:1)、无水乙醇、75% 乙醇、TE 缓冲液(pH8.0,含 RNase A)。
核心试剂:特异性目标蛋白抗体(如转录因子抗体、组蛋白修饰抗体,需验证 ChIP 适用性)、阴性对照抗体(如无关 IgG)、阳性对照抗体(如 RNA 聚合酶 Ⅱ 抗体)、Protein A/G 磁珠(预洗并封闭,用于捕获抗体 - 染色质复合物)。
2. 器材准备
离心机(冷冻型,支持 12,000×g)、超声破碎仪(配备细胞破碎探头)、移液器及吸头(无 RNase/DNase)、离心管(1.5mL/15mL,无 RNase/DNase)、磁力架、恒温摇床(4℃)、恒温水浴锅、通风橱、电泳仪、凝胶成像系统、qPCR 仪(或高通量测序平台)。
3.样本预处理
细胞样本:培养对数生长期细胞,调整细胞密度至 1×10⁷ cells / 样本,收集细胞于 15mL 离心管,4℃、300×g 离心 5 分钟,弃上清,用预冷 PBS 洗涤 2 次,重悬于 1mL PBS 中(保持细胞活性)。
组织样本:取新鲜组织(50-100mg),用预冷 PBS 冲洗去除血液杂质,剪碎后加入 5mL PBS,使用组织匀浆机制成单细胞悬液,4℃、300×g 离心 5 分钟,弃上清,PBS 洗涤 2 次,重悬于 1mL PBS 中。
二、交联固定(保留 DNA - 蛋白质相互作用)
向细胞悬液中加入 16% 甲醛溶液(终浓度 1%),轻轻颠倒混匀,室温孵育 10 分钟(交联时间需优化,避免过度交联导致超声破碎困难)。
加入 1.25M 甘氨酸溶液(终浓度 0.125M),室温孵育 5 分钟,终止交联反应。
4℃、300×g 离心 5 分钟,弃上清,用预冷 PBS 洗涤细胞 2 次,每次洗涤后离心收集细胞,最终弃尽 PBS,得到交联后的细胞沉淀。
三、细胞裂解与核分离
向细胞沉淀中加入 1mL 细胞裂解液(含蛋白酶抑制剂),冰上孵育 10 分钟,裂解细胞质膜。
4℃、600×g 离心 5 分钟,弃上清,收集细胞核沉淀(沉淀物为半透明絮状)。
向细胞核沉淀中加入 300μL 核裂解液(含 1% SDS、蛋白酶抑制剂),轻轻吹打混匀,冰上孵育 10 分钟,裂解核膜,释放染色质(此时溶液呈粘稠状)。
四、染色质超声破碎(获得目标长度片段)
将核裂解液转移至专用超声破碎管,置于冰浴中(超声过程中保持样本低温,避免蛋白降解)。
设置超声参数(需预实验优化,如功率 30%、超声 10 秒、间隔 20 秒、循环 10-15 次),将染色质破碎为 200-500bp 的片段(该长度适合后续免疫沉淀及 PCR 扩增)。
超声结束后,4℃、12,000×g 离心 15 分钟,取上清(含破碎后的染色质片段),即为 ChIP 样本储备液。
取 5μL 储备液,加入 1μL RNase A,37℃孵育 30 分钟,再加入 5μL 6×DNA 上样缓冲液,1% 琼脂糖凝胶电泳验证片段长度(目标条带集中在 200-500bp)。
五、免疫沉淀(富集目标蛋白结合的染色质)
取 200μL 染色质储备液,加入 800μL ChIP 稀释缓冲液(降低 SDS 浓度,避免影响抗体结合),轻轻混匀,得到染色质稀释液。
取 10μL 染色质稀释液作为 “Input 对照”(用于计算免疫沉淀效率),加入 90μL TE 缓冲液,-20℃保存备用。
向剩余染色质稀释液中加入 5μg 特异性目标蛋白抗体,阴性对照管加入 5μg 无关 IgG,阳性对照管加入 5μg 阳性对照抗体,4℃恒温摇床缓慢孵育过夜(12-16 小时,确保抗体与目标蛋白充分结合)。
提前将 Protein A/G 磁珠用 ChIP 洗涤缓冲液预洗 3 次,重悬于 50μL 洗涤缓冲液中,向各样本管中加入磁珠悬液,4℃恒温摇床孵育 2 小时,捕获抗体 - 染色质复合物。
将样本管置于磁力架上,吸附磁珠,弃上清,保留磁珠 - 复合物沉淀。
六、多轮洗涤(去除非特异性结合杂质)
向磁珠沉淀中加入 1mL 预冷低盐缓冲液,轻轻颠倒混匀,室温孵育 5 分钟,磁力架吸附磁珠,弃上清。
加入 1mL 预冷高盐缓冲液,重复洗涤步骤(室温孵育 5 分钟,磁力架吸附弃上清)。
加入 1mL 预冷锂盐缓冲液,重复洗涤步骤。
加入 1mL 预冷 TE 缓冲液,重复洗涤步骤(共 4 轮洗涤,确保去除未结合的染色质、游离抗体等杂质)。
最后一次洗涤后,尽量吸尽残留上清(避免杂质干扰后续实验)。
七、洗脱与解交联(释放目标 DNA 片段)
向磁珠沉淀中加入 250μL 洗脱液,轻轻吹打混匀,室温孵育 15 分钟(期间每隔 5 分钟轻轻颠倒混匀一次,促进复合物洗脱)。
磁力架吸附磁珠,将洗脱液转移至新的离心管中(此时洗脱液含抗体 - 蛋白 - DNA 复合物)。
向 Input 对照样本中加入 25μL 5M NaCl,向洗脱液样本中加入 10μL 5M NaCl,65℃恒温水浴锅孵育 4 小时(或过夜),使 DNA 与蛋白质完全解交联。
向各样本中加入 1μL RNase A(10mg/mL),37℃孵育 30 分钟,降解 RNA 杂质。
加入 1μL 蛋白酶 K 溶液(20mg/mL),45℃孵育 1 小时,降解蛋白质(包括抗体、目标蛋白及酶类)。
八、DNA 纯化回收(获得纯净目标 DNA)
向各样本中加入等体积酚 - 氯仿 - 异戊醇混合液(25:24:1),剧烈涡旋混匀 1 分钟,4℃、12,000×g 离心 10 分钟。
小心吸取上层水相(含 DNA)至新的离心管中,避免吸入中间蛋白层。
加入等体积氯仿,涡旋混匀 30 秒,4℃、12,000×g 离心 10 分钟,再次吸取上层水相(进一步去除酚类杂质)。
向水相中加入 2 倍体积无水乙醇、1/10 体积 3M NaAc(pH5.2),轻轻颠倒混匀,-20℃静置 30 分钟(或过夜),沉淀 DNA。
4℃、12,000×g 离心 15 分钟,弃上清,得到 DNA 沉淀。
加入 1mL 75% 乙醇,轻轻颠倒洗涤 DNA 沉淀,4℃、12,000×g 离心 5 分钟,弃上清。
室温倒置离心管,晾干 DNA 沉淀(避免过度干燥导致 DNA 难溶解),加入 20-50μL TE 缓冲液(含 RNase A),4℃溶解过夜(或 37℃孵育 30 分钟加速溶解)。
用 Nanodrop 检测 DNA 浓度及纯度(A260/A280 比值应在 1.8-2.0 之间,确保 DNA 纯净)。
九、检测分析(验证目标 DNA 片段)
1. qPCR 检测(定量分析结合效率)
设计目标基因结合区域的特异性引物(如转录因子结合位点上游 / 下游序列),同时设计无关区域引物作为阴性对照。
以纯化后的 IP 样本 DNA、Input 对照 DNA 为模板,进行 qPCR 反应(反应体系:2×qPCR Mix 10μL、引物各 0.5μL、DNA 模板 2μL、ddH₂O 7μL)。
反应程序:95℃预变性 5 分钟;95℃变性 10 秒,60℃退火 30 秒,72℃延伸 30 秒,40 个循环;熔解曲线分析验证引物特异性。
计算免疫沉淀效率:采用 2^(-ΔΔCt) 法,以 Input 对照为基准,比较 IP 样本与阴性对照(IgG 组)的目标区域富集倍数(富集倍数>2 倍视为有效结合)。
2. 测序分析(ChIP-seq,全基因组筛选结合位点)
3.
对纯化后的 DNA 样本进行文库构建(末端修复、加 A 尾、接头连接、PCR 扩增)。
文库质量检测合格后,进行高通量测序(如 Illumina 平台),获得原始测序数据。
数据处理:原始数据过滤、比对到参考基因组、峰 calling(如 MACS2 软件),筛选目标蛋白结合峰。
生物信息学分析:结合峰注释(基因启动子、增强子等区域)、GO/KEGG 功能富集分析、Motif 分析(预测目标蛋白结合基序)。
关键注意事项:
交联步骤是实验核心:甲醛终浓度需严格控制在 1%,孵育时间不宜过长(5-10 分钟),避免染色质过度交联导致超声破碎不完全;甘氨酸终止需充分,防止残留甲醛影响后续反应。
超声破碎条件需个体化优化:不同细胞 / 组织的染色质硬度不同,需通过预实验调整超声功率、时间和循环数,确保片段长度集中在 200-500bp(过长或过短都会影响 IP 效率)。
抗体选择至关重要:需使用经 ChIP 验证的特异性抗体(避免使用仅适用于 WB/IHC 的抗体),阴性对照(IgG)需与一抗物种一致,阳性对照用于验证实验体系有效性。
全程需抑制核酸酶和蛋白酶:所有裂解液、洗涤液需新鲜加入蛋白酶抑制剂,样本处理全程保持低温(冰上或 4℃),避免 DNA 降解和蛋白变性。
洗涤步骤需充分但温和:多轮洗涤可降低背景,但操作需轻柔,避免剧烈涡旋导致磁珠 - 复合物脱落;最后一次洗涤后需尽量吸尽上清,减少杂质残留。
解交联需彻底:65℃孵育时间不少于 4 小时,确保 DNA 与蛋白质完全分离,否则会影响 DNA 纯化效率和后续检测结果。
DNA 纯化过程需谨慎:酚 - 氯仿抽提时避免吸入中间蛋白层,乙醇沉淀时可加入糖原(10μg / 样本)提高低浓度 DNA 回收率。
实验对照不可缺少:Input 对照用于计算富集效率,阴性对照(IgG)用于排除非特异性结合,阳性对照用于验证实验体系稳定性,三者缺一不可。
Related Promotional Journal Downloads